21世紀經濟報道記者唐唯珂 實習生李妍靜 廣州報道 近期,國內防疫措施逐步優化。雖然針對新冠病毒最有效的仍是疫苗,但隨著新冠特效藥逐漸引發關注,其也成為疫苗之外備受追捧的產業賽道。
據中國醫藥公告,12月14日,中國醫藥健康產業股份有限公司與輝瑞公司簽訂協議,將在協議期內負責輝瑞公司新冠病毒治療藥物奈瑪特韋片/利托那韋片(Paxlovid)在中國大陸市場的進口和經銷。這給國內企業的在研新冠特效藥提供了期望,不少企業也逐漸加入新冠特效藥的賽道,紛紛開展藥物臨床試驗。
12月20日,21世紀經濟報道記者在相關試藥招募平臺上搜索發現,目前關于新冠病毒特效藥的臨床試藥招募基本都已結束。現搜索試藥平臺,僅有科興制藥的SHEN26臨床試驗依舊在招募相關志愿者,成功入組的志愿者,可獲得包括交通、誤工、營養補助加上依從性獎勵總共約5200元。
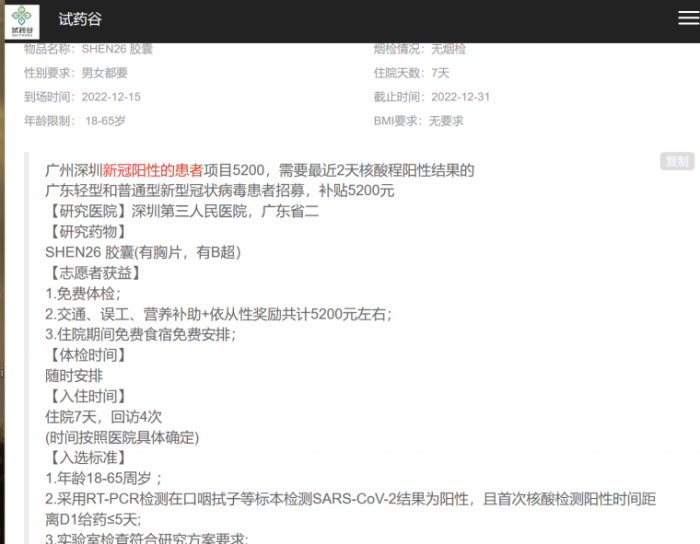
(圖:科興制藥在“試藥谷”平臺上發布SHEN26的試藥志愿者招募,地點位于深圳市第三人民醫院和廣東省第二人民醫院,7天試驗補貼近5200元)
許多新冠特效藥臨床試驗招募在發布后,短時間內就招滿了志愿者。而在行業層面,藥企也需不斷加快腳步,留給企業研發新冠特效藥的時間也不多了。
一招即滿 臨床試驗增多
12月13日,廣州中山大學附屬第三醫院(以下簡稱“中山三院”)感染性疾病科在公眾號上發布招募輕型或普通型新冠感染者治療藥物受試者,以完成RAY1216片治療輕型和普通型SARS-CoV-2感染患者的隨機、雙盲、安慰劑對照Ⅲ期臨床研究(方案編號RAY1216-22-02)。RAY1216為廣東眾生瑞創生物科技有限公司在研新冠特效藥。而在次日,中山三院感染性疾病科公眾號再度發布公告,顯示招募已滿。招募的公告在12月11日發布,短短三天,招募就已
結束。

(圖:中山三院完整公告內容)
21世紀經濟報道記者在試藥招募平臺上點進一個近期招募結束的試藥臨床項目。根據平臺上顯示,藥品為舒泰神(北京)生物制藥股份有限公司(以下簡稱“舒泰神”)的STSA-1002/STSA1005,用于治療新冠肺炎,八天試驗報酬高達12000元。
據舒泰神官網顯示,STSA-1002注射液和STSA-1005注射液尚處于保密階段,暫無可公開信息。但此前舒泰神于8月收到國家藥品監督管理局簽發的STSA-1002注射液和STSA-1005注射液聯合治療重型、危重型新型冠狀病毒肺炎的《藥物臨床試驗批準通知書》,同意本品開展用于針對治療重型、危重型新型冠狀病毒肺炎的臨床試驗。
眾多藥企期望能在新冠特效藥的研發上搶得先機。
藥物臨床試驗是藥物研發中最關鍵的一環,是驗證新藥有效性和安全性必不可少的步驟。而在臨床試驗中,招募合適的患者是主要挑戰。據IQVIA市場調研數據表明,高達48%的臨床研究項目因為不能按計劃完成患者招募和入組而受阻。
對于新藥的研發而言,招募到合適的志愿者可以大大提升臨床試驗的速度,這也意味著新藥能夠更快上市,在同一靶點機制的藥物研發中處于領先地位,更有可能成為這個類別的First-in-class,從而占據更大的市場空間和利潤。
輝瑞Paxlovid可在中國大陸市場進口和經銷的消息,讓不少藥企看到新冠藥物獲批的希望,紛紛開展相關藥物臨床實驗,招募志愿者。
在新冠疫情防控措施調整前,因國內感染者較少,開展藥物臨床試驗難度較大,多數藥物研發需在海外招募志愿者開展臨床試驗。而隨著新冠陽性感染者的群體不斷擴大,志愿者人數增多,也方便企業啟動臨床試驗。據中國臨床試驗注冊中心的數據,探究新冠藥物治療的試驗正在增多,與COVID-19相關的試驗達1117個。
多家藥企紛紛加速臨床試驗,期望在這一賽道撥得頭籌。
千億市場引藥企競折腰
作為抗疫必備品,新冠藥物的市場空間巨大,將給國內相關公司帶來巨大的增長機遇。
從藥物結構特性來看,新冠藥可分為小分子化學藥和大分子生物藥兩大類。其中,生物藥包括中和抗體和膜融合抑制劑兩種,中和抗體雖在治療重癥方面提供了有效的補充,但在治療上存在明顯的短板,而膜融合抑制劑又多處于研發早期階段。
因此,相較于大分子藥物,小分子新冠藥更具有優勢。其生產成本更低、使用便捷、適應癥廣,居家自行服用可以避免醫院交叉感染、降低社會成本。此外,小分子新冠藥可在常溫下存儲運輸,快速實現全球分發。
國聯證券認為,除滿足治療需求外,新冠藥還可具備預防功能,且預防的需求遠高于治療需求。按照歷史經驗估計每年有癥狀患者有1億,小分子新冠藥治療的全球市場規模為每年400億美元;小分子新冠藥預防市場規模為治療的2倍以上,潛在市場規模在千億美元級別。
龐大的市場空間自然引得多家企業爭先恐后涌入這一賽道。
目前,國內已有兩款新冠口服小分子藥物獲批上市,分別是輝瑞的Paxlovid和真實生物的阿茲夫定,價格分別為2300元/盒(醫保采購價)和270元/瓶(參考各地醫保掛網價)。而默沙東的新冠口服藥莫努匹韋(Molnupiravir)也已在中國遞交上市申請。
與此同時,君實生物的VV116、先聲藥業的SIM0417、開拓藥業的普克魯胺等新冠藥物處于臨床III期階段,屬研發進展第一梯隊。
除了上述研發進展靠前的企業,近期包括科興制藥、石藥集團、歌禮制藥等多家上市藥企也集中披露了在研新冠藥物的臨床進展,或相繼切入新冠口服藥賽道。
此外,還有后來者正切入新冠藥物賽道。比如長江健康通過收購入局新冠口服藥賽道,其全資子公司收購的江和藥業正在進行抗新冠口服小分子創新藥CH2101的自主研發,該藥物針對RNA聚合酶(RdRp)靶點,目前正處于臨床I期階段。
多家企業新冠藥物臨床試驗正進行得如火如荼。然而,不少已經感染的患者表示,如果服用普通的感冒藥,對癥下藥,在7天內也能達到治療效果,不一定要購買新冠特效藥。多個有新冠陽性經歷的患者表示,常用于退燒的布洛芬、治療感冒的泰諾等藥,對于癥狀的緩解可以起到作用。治療咽喉不適等附加癥狀,市面上也有近百種藥物可以選擇。
中國工程院院士鐘南山也曾表示,“感染新冠是一個自然規律,我們不是主動地去得病,但是由于它的傳播性強,大概率有可能會感染。但是時間拖得越晚,估計感染以后,出現嚴重的癥狀的機會就越來越少”。這意味著,隨著疫情的發展,越晚感染的患者病狀或許會越來越輕,新冠病毒的毒性或許也將不斷減弱,特效藥之外的其它普通病癥也需要對癥下藥的藥品。
進入攻關期 存在不確定性
阿茲夫定的獲批給市場注入強烈信心的同時,眾多藥企也加緊研發進度,進入藥品研發的攻關時期。
12月15日,廣生堂發布公告,其控股子公司研發的新冠口服小分子藥物GST-HG171于近日獲得啟動II/III期臨床試驗的倫理委員會審查批件。此外,悅康藥業、華潤雙鶴、石藥集團等藥企也先后拿到自研新冠藥物的臨床試驗批文。
對于這類公共衛生事件和重大傳染性疾病,早期預備研發極為重要,且有賴于中長期戰略布局、統籌規劃、資源合理分配以及可持續性研究投入,先進入的藥企或許會愈來愈強,后來者恐很難追上。對于多數加入新冠藥物研發的企業來說,某種程度上“時間就是金錢”,能否越快研發出新的藥品并有效轉換成利潤成為未來發展的關鍵。從各家企業研發的進度來看,目前進度較快,進入III期臨床的大多是在疫情早期就布局這一賽道的創新藥企。
中國中醫科學院廣安門醫院國際醫療部主任醫師龐博認為,抗新冠病毒口服小分子藥物在國內大規模上市應用已是指日可待。他進一步表示,新冠口服藥研發具有較大的風險,病毒變異較快,能否做出顯著性差異有較大的不確定性。同時,由于各國的疫情防控政策也有不確定性,疫情的發展處于動態變化中,研發上市成功的新冠口服藥的放量也存在不確定性。另外,目前新冠口服藥研發公司頗多,進度落后的企業或比較難開拓市場,而且隨著越來越多的新冠口服藥上市,價格可能會出現下降趨勢。
此外,臨床試驗數據的缺乏和是否能追趕上短期內緊急的情況,也是研發人員需要關注的。

















